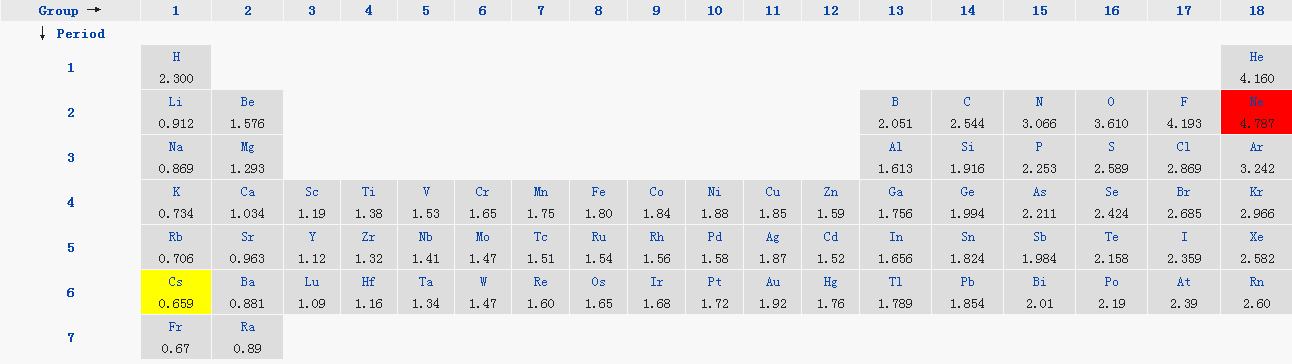
电负性的比较1同一周期,原子序数越大,电负性的值越大2同一主族,院子序数越大,电负性的值越小3不同主族不同周期的元素之间的比较,很复杂,无法得出一个简单判断法通常采用的是Pauling法跟Allen法,尤其是Pauling法 就简单记吧 周期表中,同主族金属性从上向下依次增强,同周期非金属性从左至右依次增强。
1一般来说,周期表从左到右,元素的电负性逐渐变大周期表从上到下,元素的电负性逐渐变小过渡元素的电负性值无明显规律2一般来说,电负性大于18的是非金属元素,小于18的是金属元素,而位于非金属三角区边界的“类金属”如锗锑等的电负性则在18左右,它们既有金属性又有非金属。
例如,如果元素倾向于形成负离子或共享电子对中的负部分,那么它的电负性就相对较大反之,如果元素倾向于形成正离子或共享电子对中的正部分,那么它的电负性就相对较小综上所述,通过考虑元素的非金属性在周期表中的位置以及形成化学键的倾向性等因素,可以较为准确地判断元素的电负性大小。
元素的电负性是一个衡量元素在化学键中吸引电子能力相对强弱的标度一般来说,可以通过以下几个方面来比较元素的电负性大小首先,元素在周期表中的位置是关键在同一周期中,从左到右,随着原子序数的增加,元素的电负性通常逐渐增大这是因为随着核电荷数的增加,核对核外电子的吸引力增强,使得元素在。
电负性越大非金属性越强,否则非金属性越弱,即金属性越强化学中规定氟的电负性 为398,其他元素与其相比较,而具有相对的电负性电负性大于18的是非金属元素,小于18的是金属元素,而位于非金属三角区边界的“类金属”如锗锑等的电负性则在18左右,它们既有金属性又有非金属性元。
通常,电负性大的元素集中在元素周期表的右上角,而电负性小的元素则集中在左下角具体来说,从左到右即周期表中横向,元素的电负性逐渐增大从上到下即周期表中纵向,元素的电负性逐渐减小例如,氟的电负性最大40,因此它是最容易参与反应的非金属元素而电负性最小的元素铯,其。
1随着原子序号的递增,元素的电负性呈现周期性变化2同一周期,从左到右元素电负性递增,同一主族,自上而下元素电负性递减对副族而言,同族元素的电负性也大体呈现这种变化趋势因此,电负性大得元素集中在元素周期表的右上角,电负性小的元素集中在左下角3非金属元素的电负性越大,非金属元素越。
化学元素周期表的电负性排序是根据元素的非金属性强弱进行的在周期表中,非金属性越强的元素,其电负性通常也越大这是因为电负性是衡量元素在化学键中对电子吸引能力的相对大小非金属性强的元素,如氧氟等,它们对电子的吸引力较强,因此具有较高的电负性从周期表的具体排列来看,同周期元素从。
电负性的比较 电负性是元素的原子在化合物中吸引电子的能力的标度1元素的电负性越大,表示其原子在化合物中吸引电子的能力越强又称为相对电负性,简称电负性,也叫电负度电负性综合考虑了电离能和电子亲合能,用来表示两个不同原子间形成化学键时吸引电子能力的相对强弱,是元素的原子在分子中吸引共用电子的能力通常以希腊字母χ为电负性的符号。
同主族随核电荷数增多,原子半径逐渐增大同种元素 核外电子数越多,粒子半径越大 如 HHH+ FeFe2+Fe3+结构相同的离子 质子数越多,离子半径越小如 N3O2FNa+Mg2+Al3+ P3S2ClK+Ca2+ 二电负性 同周期 随核电荷数增多,电负性逐渐。
元素的电负性是一个衡量元素在化学键中吸引电子能力强弱的指标在元素周期表中,电负性通常呈现出一种规律性的变化一般来说,非金属元素的电负性较高,它们具有较强的吸引电子能力,容易形成负离子例如,氟F是电负性最高的元素,它几乎总是以负一价离子的形式出现在化合物中随着原子序数的增加。
元素的电负性顺序是一个衡量原子在化合物中吸引电子能力强弱的相对标度,其顺序并非固定不变,但总体上遵循一定的周期性规律在元素周期表中,从左到右同一周期元素的电负性逐渐增加,这反映了随着原子序数的增加,原子核对外层电子的吸引力增强而从上到下同一主族,元素的电负性则逐渐减小,这。
解释电负性是描述元素在化合物中对电子吸引能力的参数元素的电负性大小反映了该元素的非金属性强弱和金属性强弱的特点对于非金属元素来说,其电负性较大,说明它们在与其他元素形成化合物时更容易吸引电子而对于金属元素来说,其电负性较小,因为它们更倾向于失去电子在同一周期的元素中,从左到右。
其中主族元素和过渡族元素的性质也有所不同,主族元素的电子云外层电子均位于s或p壳层,更容易与其他元素形成化合物,并且金属性和非金属性的变化也比较显著而过渡族元素的性质则更为复杂,因为其外层电子位于d壳层,形成了一些有趣的化学性质,如氧化态非常多样和颜色变化等总的来说,电负性是元素。
在化合物中吸引电子的能力相对较弱,形成的共价键极性也相对较小综上所述,氮原子的电负性强于硫原子,这一结论基于电负性的定义氮原子与硫原子的电负性数值比较以及电负性强弱对化合物性质的影响在化学研究和应用中,了解元素的电负性有助于我们更深入地理解化合物的结构和性质。
氧氮硫磷碳氢2 电负性小于零,金银铜汞铅这个口诀描述了元素的电负性大小顺序在元素周期表中,氧氮硫磷碳氢等元素的电负性大于1,而金银铜汞铅等元素的电负性小于0电负性是衡量元素原子在分子中吸引电子能力的指标口诀中元素的排列顺序反映了它们原子吸引电子能力的强弱。
电负性是一种化学性质,用于描述原子在化合物中吸引电子的能力其大小体现了元素的非金属性强弱电负性的概念是基于电子分布和原子对电子的吸引力在化学中,电负性越高的元素,其原子在化学键中吸引电子的能力就越强这种吸引力反映了元素的非金属性质一般来说,非金属元素的电负性较高,因为它们。
转载请注明来自德立,本文标题:《如何比较元素的电负性强弱》


 京公网安备11000000000001号
京公网安备11000000000001号 京ICP备11000001号
京ICP备11000001号
还没有评论,来说两句吧...